【运营总监系列一】临床运营管理组织架构与职责分工
发表时间:2024-01-23 22:31:54 来源:浩瀚游戏中心app
申办方和CRO的临床运营主管/总监,整合内外部资源确保在研管线品种临床试验项目输出稳健一致。行业竞争加剧、法规更迭频繁、经济趋低、疫情限制随访、预算削减等大背景下,临床开发主管面临更多挑战:在保持成本的同时减少相关成本压力、保持质量和提高运营效率。
申办方和CRO,全球临床运营部,发生运营模式的不断变迁。合并、收购、并购、外包、精简和战略联盟已成为业界新常态:申办方开办CRO和SMO,以图关键项目的试验加强控制或集中化运行以中枢调配资源实行效率最大化。
国外,依赖于研究者、伦理委员会、申办方的职业化分工,基建良好的基础上,研究者商业化运作、MCC搭建起申办方外包的绩效矩阵平台、CTTI搭建起药政当局在数据质量与实施效率动态优化平台、ACRP搭建起CRA与CRC从业的基础上,自由外包CRA、QA成为行业一种现象。RPS的嵌入型服务也是CRO模式的一种。
缺乏这些,中国的每个临床总监,都只能选择招聘人员和外包项目两种方法去实施临床试验,构建质量运营体系、重新培训普遍存在效率低下和费时而且不专业的严重弊端。
随着中国临床试验行业的持续不断的发展,趋势渐进明确:新的临床开发运营模式将以伙伴关系为驱动之一。
合作伙伴可提供全球能力、灵活的资源池和支持进行大型全球试验所需的技术,以及管理广泛的产品组合。国内申办方在欧美国家申报临床试验,仍委托国际CRO的做法,一方面要专业庞大的监管团队但自身缺乏,另一方面这些合作方式今时今日已严重落伍。
一些申办方试图限制与他们合作的临床试验外包合作伙伴数量,但委托研究仍然需要大量专业技能。
与合作伙伴实现战略与运营的统一的目标仍然是全球药厂外包CRO过程中所面临的最大挑战,MCC倡导的绩效矩阵外包和全球主流的基于研究可交付成果外包模式,在固定成本总价合同与服务费合同中都继续存在一些难以逾越的合作障碍。
加深行业更紧密的联系,申办方需根据管线品种、临床治疗领域、现有团队能力优势,匹配外包团队、确定建立伙伴关系的最正确方向以帮助实现目标。
CTSO俱乐部,依赖CTBMI平台,拥抱国际趋势,整合全球临床运营管理理念和反思最佳实践,引进全球虚拟临床组织的运营模式。他绝不是“自由外包CRA”这种偷偷使用其他厂家CRA干私活自己收巨额服务费的X研社能想出来的。
通过CTBMI平台、依赖于CTSO俱乐部成员,这种临床虚拟网络合作伙伴具备卓越优势:
-接受标准、一致的培训:CRA、Trial Manager、运营总监、QA能快速高效开展工作,降低不必要的培训成本,提升质量、优化效率
-信任合作伙伴关系:俱乐部会员三年来,相互熟悉、信赖,共同高速成长,人品佳,认可阳思明语企业价值观-正直、善良、诚信的基本做人准则,深受雇主认可
-理念一致:能迅速高效构建起一套共同的战略目标,确保经营业务稳健一致的输出
-协作能力强:借助于CTSMO系统的理论基础、实践技能,各小组成员开展工作,遵循集成业务流程支持,能实现实时协作的技术,可提供一致的性能
-可替代性强:建立CRA、PM、MA、QA这四个关键岗位,不论城市、公司、工作年限、级别或公司从属关系,均能提供稳定一致的绩效输出。完全解决那种换个CRA,做法截然不同的内源性差异
这种新兴模型,目前在中国只有阳思明语,我们阐述这种理念和实施,与传统供应商或首选供应商不同伙伴关系的不同以及成功关键因素。
我们的俱乐部会员来自内资外资和不同制药细分行业,通过长期服务,我们实现行业的标准化、统一化,在医疗器械、小分子、中成药、大分子临床试验管理中达成协调一致,WBS和PBS的对应。在此基础上实现可交付成果、工作列表、预算的运营管理。

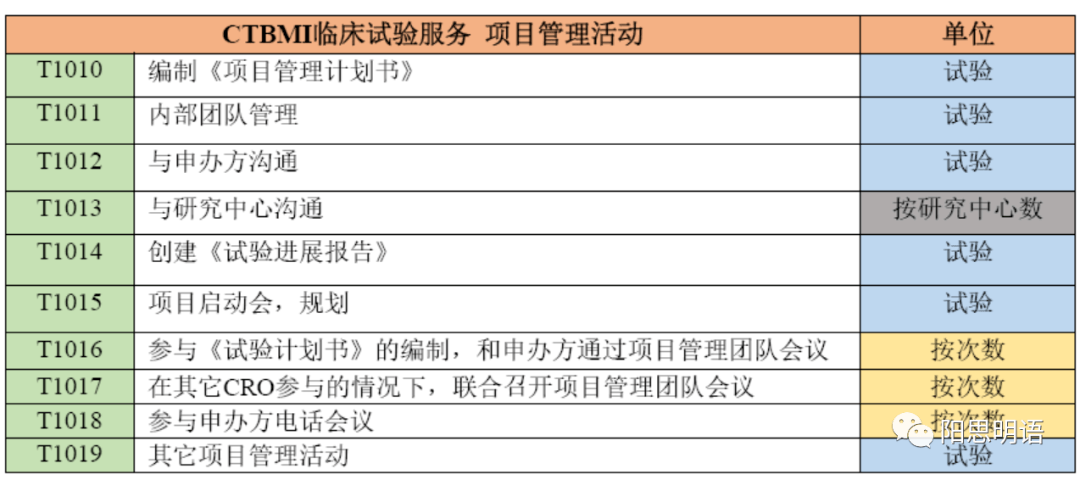
我们提供Trial Manager的标准培训,也直接向申办方提供FTE租赁服务,标准、透明、灵活的用工解决方案,背后是我们数百位行业精英为支撑。我们期望更多的专业素质过硬人员加入俱乐部,也欢迎企业像我们采购,改善临床试验管理上的水准,扔掉那不知所云的SOP。
供应商CRO一直在临床试验扮演着举足轻重的角色; 但是,申办方与CRO之间的合作伙伴关系性质,从短期委托项目以操作实施为重点发展到长期战略合作伙伴关系。申办方期望能寻找到最恰当的CRO,这种合作伙伴能够与他们的战略目标保持高度一致,将带来时间、成本和运营效率方面的提升与优化。
逐个试验基于最低价外包的策略,对申办方来说,存在重大的供应商管理挑战。如此众多的供应商CRO,对申办方来说很难管理供应商体现最佳绩效:不同CRO的SOP不同、做事方法不同、合同类型不同、关键文档不同。
直到今天,中国绝大部分制药厂家,选择合作伙伴还是在逐个项目分别外包试验的管理方式。
实际上,每个PM都有能力通过RFP流程选择供应商(阳思明语的全套Vendor筛选与管理策略更加专业高效)。但是,逐个项目分别外包策略带来重大的供应商管理挑战,这和外包的出发点相背离:外包本质,在于租赁外部资源去实施本该由内部团队进行的活动和过程。
如此多供应商,对Sponsor监管团队来说,很难体现管理供应商的绩效。为了控制质量、缺乏有效PM监管CRO,许多申办方被迫同意让供应商CRO用他们的标准操作程序(SOP)和技术(例如临床电子试验管理系统数据采集与IWRS)。
这一做法,延长双方熟悉时间、团队培训时间,将研究团队的灵活性降低到采用新的流程和技术带来项目风险倍增的不利后果。申办方还意识到RFP和供应商签约过程会造成不必要的研究启动的延迟。但是,缺乏人才,导致许多较小的初创企业(小分子和生物技术公司)接着使用这种伙伴关系模式。
近年来,在提高质量的同时期望最大限度地减少相关成本并缩短研究关键里程碑,已导致许多大型制药公司成立首选供应商关系和独家合作伙伴关系。例如强生选择XX和XX,罗氏国内IV期项目选择XX而III期临床选择XX。
中国CRO都需要走过这条路:低价格中标外企项目,以向行业证明他们具备为外企服务的资历,再去赚有利润可图的项目和申办方。
这种伙伴关系为双方带来共赢:CRO能具备行业定价权而不是一味接受价格,申办方能相对减少启动时间。
国际上许多大药厂,仍在沿袭这一做法,已成功开发出供应商管理团队,以每年动态调整Vendor List的方式,让两个合作伙伴乖乖听话,每年都要优化运营能力、改善实施效率、提升合作意愿度、快速植入响应措施。
哪怕中国Top3的巨头企业,临床运营也一塌糊涂。从外企跳槽而来的数十名总监,相互不服,导致企业不可能有SOP,这是事实。
内耗严重的背景下,如何改善效率?阳思明语身为咨询师,为行业提供解决方案。
通过CTBMI,申办方、CRO,借助于标准化机构研究者伦理流程,能完美合作,网络交织,协调战略和运营目标,达成新的合作方式。
对于申办方而言,这在某种程度上预示着,通过促进整个ProcessMap参与过程植入技术变革,并参考CRO合作伙伴排名以实现最佳绩效兑现关键流程碑,通过阳思明语咨询师,确定合同约定的成本和质量目标可不可靠、市场公允价值。
对于FSP功能服务提供商,临床研究组织CRO和SMO,CDMO和中心实验室其他供应商,这在某种程度上预示着在标准化之间找到适当的平衡:理解行业需求,规模经济,能为合作伙伴提供满足他们需求的定制解决方案。
成为CTBMI企业会员,申办方和CRO能够享受到《CRO监管计划》《RFP》《筛选和管理CRO》《MSA》《试验绩效标准》《试验计划》等标准服务,我们始终相信成员会慢慢的变多,规模经济会带来优势。
申办方,只需要对如何他们选择合作伙伴并开始评估潜在合作伙伴是不是具备相匹配的能力,CRO商业策略是否就是他们申办方的战略目标。相比采用传统的供应商选择标准,CTBMI新模式具有非常明显优势:
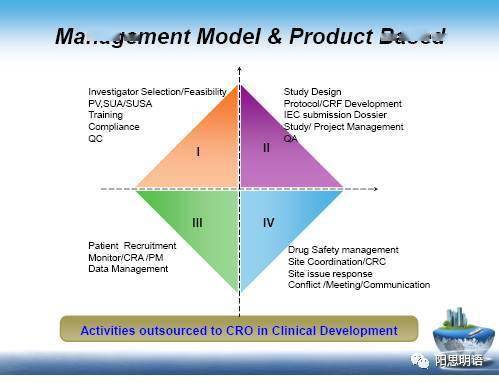
以最经常采购的试验管理、方案开发、研究设计、监查职能举例,传统外包选择和CTBMI的差异:
商务来回参加会议,寻找项目的老传统,在网络时代已经落伍。如何确保双方匹配、对焦,CTBMI整合战略目标和运营策略。
CTBMI解决目前存在的许多障碍:困扰传统伙伴关系—错位目标、缺乏共同投资和竞争优先事项。例如,你的项目外包给巨头CRO结果人家不care你,给你的上市带来严重阻碍;你的项目外包给不专业的CRO,导致疗效出现严重临床错位,巨额投资打水漂。
过去三年半,阳思明语整合FDA临床开发指南、NHS、CTTI、MCC、ACRP、NCI、NIH等,琢磨适用于中国环境的架构。为企业订制SOP、提供培训、为PD-1/PD-L1、修美乐中国首家上市都贡献出关键力量和资源注入,不断修正CDP、Trial Plan和众多研发文档工具。
每位临床运营总监,都可优先考虑加入CTBMI,我们共同开发、分享,集思广益,不断强化以下临床运营目标:
申办方需求往往在于,想将合作伙伴CRO纳入他们的战略规划,确保合作伙伴真正了解的品种临床开发过程所面临的挑战。
这将帮助合作伙伴进行战略思考,关于如何帮助解决申办方的问题最紧迫的业务问题。
每位运营总监的加入,能够最低成本(2万块)享受这些标准文档和服务,接受全球最优认知和最佳实践,胜任高级职位。
同时,CTBMI每年都将组织内部会议,讨论运营总监的成熟度提升,制定切实可行的措施,改进目标和承诺资源投入,确保实现运营目标。这些理念,可完全植入企业内部运营场景。
CTBMI对会员有承诺,每个临床组织同样必须有一个对合伙企业的财务承诺:合作伙伴一起成功或失败。也就是说,战略计划必须有投资支持以及基于奖励的奖励。
三年前,阳思明语呼吁成立MCC、CTTI这样的组织,但众所周知中国的协会成立之难、实际运作几乎是零的现状。我们转而成立CTBMI,以个体聚集的方式,影响整个行业。
在CTBMI标准指引下,申办方与CRO的高级领导组织应成为治理的一部分结构体。
低水平的申办方PM和CRO的PM相互指责,那不是CTBMI运营总监的格局。
CTBMI水平下,双方总监的治理团队,确保战略合作目标将实现,并且合作投资处于动态监视的状态:确保预算花在正确的事情上、确保事情做正确,确保人的任命是恰当的合理的。
这种高水平团队,将具备水准,业务重点放在检讨营运表现、反对偏离目标并确保表现持续改善。
签署合同时,定价应直接与成果挂钩,双方都应根据一组清晰的共享指标对其绩效负责。也就是说,“基于研究可交付成果”和“绩效矩阵外包”这些战略思想的成功植入。
一个有效的治理结构能够在一定程度上帮助确保合作伙伴建立“准备部署”资源池,可以通过CTBMI的真实会员,快速补充CRA、Trial Manager、MA和QA。
它不是那种很low的拿别人家CRA给自己干私活牟利被申办方封杀的所谓共享CRA平台X研社能具备的远见、眼光、格局、视野。
在CTBMI的Trial ProcessMap中,申办方和CRO能够遵循共同的流程、植入彼此认可的技术,推动进程:
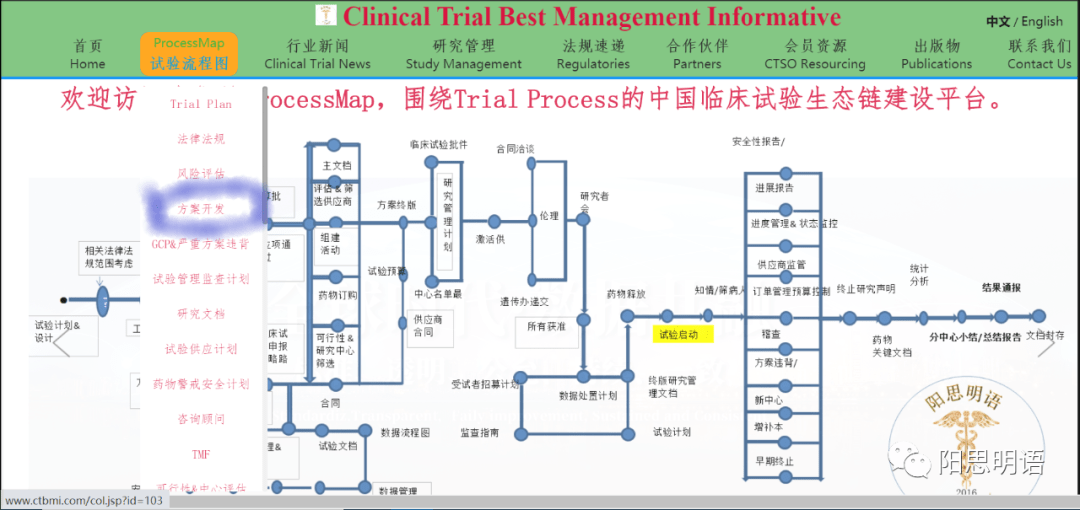
这一愿景意味着,CTBMI会员将帮助Sponsor与他们合作伙伴CRO,发展综合业务,使过程更优化,优化到超过任何一方的需要。对话将透明、清晰、标准。例如,不再欺骗人,说招募、入组、筛选、出门诊是不同的服务,导致申办方和SMO彼此不信任等行为。在我们的首页中,术语表和合同模板,将清晰的规定这些服务标准。
在CTBMI,每位运营总监都将集中精力在核心业务中,临床试验活动以最有效的方式来进行、方式和责任应该分开,以提高运营效率的方式和里程碑事件表的改进,并大幅度的降低成本而不牺牲质量。借助于我们的标准培训,机构、伦理、研究者的日益认可,这些贡献还将更加意义深远。
在这种机制下,申办方和CRO只需要仔细考虑集成流程所必须的集成技术,以支持帮助所有合作伙伴能够电子交流。有效的工具包括CTBMI未来的企业用户入口,它们能对接企业,提供实时见解和及时数据支持决策。
在未来,我们始终相信,申办方和CRO作为合作伙伴,彼此之间的数据交换需要接近实时。
传统意义上,开发综合信息架构可帮助申办方监控合作伙伴的表现并能够在一定程度上帮助建立公司之间的信任。借助于CTBMI的广泛会员(遍布于中国主流企业),我们将不断融合大数据,人工的方式汇总,并不断采购新技术,未来将减少所需流程冗余(即两个不同的个体在两个组织中表现相同任务以检查准确性,监查和稽查时)。
中国临床试验必须走Trial ProcessMap,这是成功唯一的路。我们将紧密团结所有成员,集中精力去做好CTBMI,将个体身份切换所有CRO、申办方和研究者机构伦理合作,协调他们的战略和运营目标、整合他们的业务流程,打造统一一致的人员和信息平台。